肝細胞癌(HCC)是最常見的肝惡性腫瘤,其進展與免疫系統功能密切相關。免疫檢查點抑制劑治療(anti-PD-1 /anti-PD-L1)已經成為晚期肝癌患者的一線治療方案。
然而,HCC患者長期受炎癥刺激可能會使其免疫微環境發展為對免疫治療耐藥的狀態。事實上,大多數HCC患者在免疫檢查點阻斷后都表現出耐藥性或復發,這與患者體內腫瘤免疫微環境向腫瘤免疫抑制微環境形成相關。而腫瘤免疫抑制微環境的形成與先天性免疫和適應性免疫的功能失調相關。因此重新塑造免疫微環境成為晚期HCC患者的治療策略。但不同細胞如何調節腫瘤免疫微環境,使其發展為對免疫治療產生耐藥的具體機制仍不清楚。

烈冰生物合作伙伴海軍軍醫大學東方肝膽外科醫院衛立辛、吳東團隊與復旦大學周兆才、焦石團隊針對上述問題開展了系列研究,于近期在 Journal of Hepatology 期刊發表了題為Immunosuppressive CD10+ALPL+ neutrophils promote resistance to anti-PD-1 therapy in HCC by mediating irreversible exhaustion of T cells 的研究論文。烈冰生物參與了本研究中的單細胞測序和數據分析工作。
下面我們一起了解一下本文的研究思路和數據分析過程~
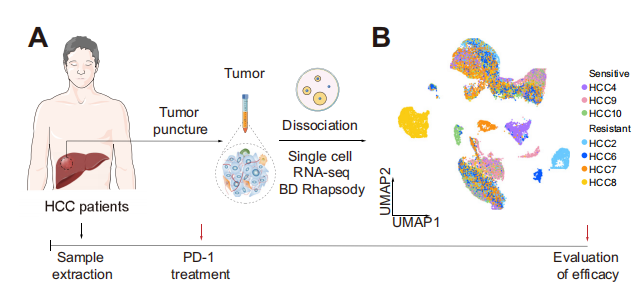
樣本:抗PD-1治療響應的HCC患者(n=3),抗PD-1治療耐藥的HCC患者(n=4)
采樣組織:腫瘤組織
單細胞捕獲平臺:BD Rhapsody
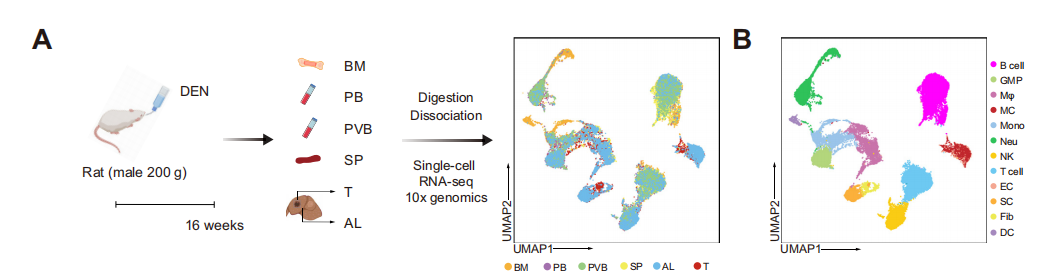
樣本:二乙基亞硝胺(diethylnitrosamine,DEN)誘導的HCC大鼠 (n=6)
采樣組織:腫瘤、鄰近肝組織、骨髓、外周血、門脈虛血、脾臟
單細胞捕獲平臺:10X Genomics
主要技術:單細胞測序(scRNA-seq)、流式細胞術、免疫熒光、蛋白質質譜、基因敲除等
Novelbrain云平臺分析工具:
細胞聚類分析、擬時序分析、速率分析、差異基因表達分析、轉錄因子分析(SCENIC)、GSEA基因富集分析、InferCNV等
01 單細胞測序初步分析與細胞類型確認
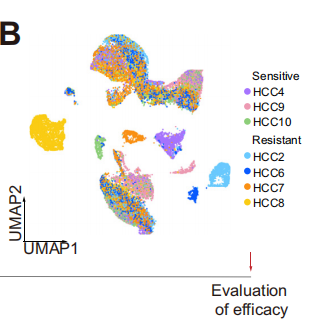
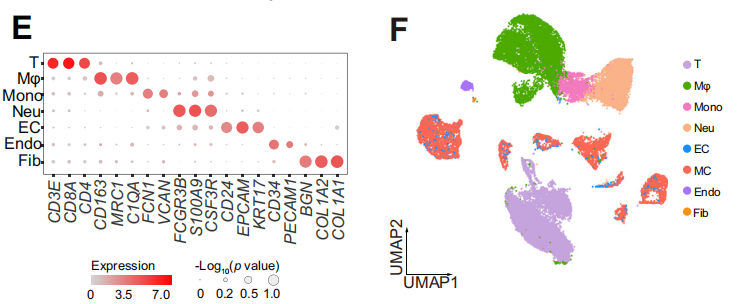
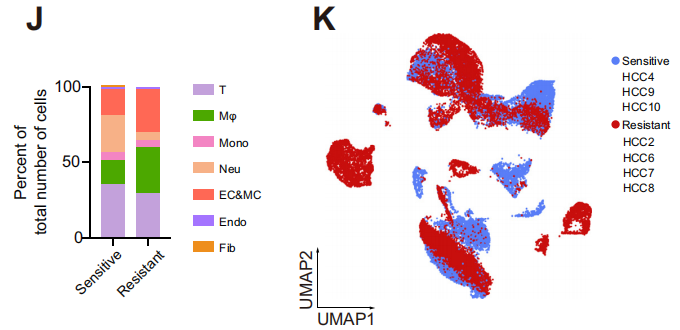
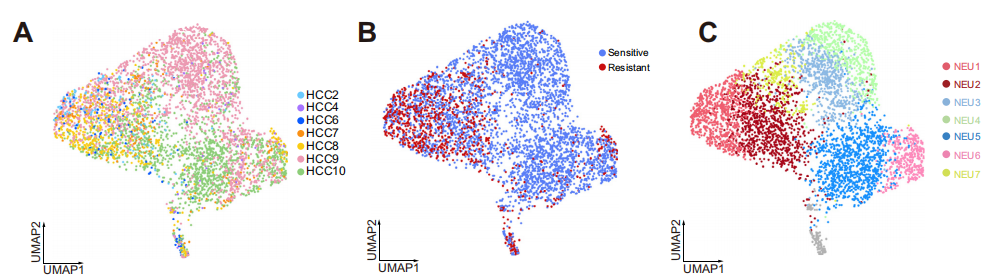
研究者對7例計劃進行抗PD-1治療的肝細胞癌患者活檢組織進行了單細胞測序,根據mRECIST標準,將患者分為抗PD -1敏感組和抗PD -1耐藥組,通過scRNA-seq來評估免疫、腫瘤和基質細胞的特性。為了保證后續分析的可靠性,研究者與烈冰的生信團隊對數據進行嚴格的質控,最終得到31,672個細胞。通過細胞聚類分析,共鑒定出7個細胞大類,并使用CNV分析,對腫瘤細胞進行惡性評分。
通過對不同樣本和分組的細胞類型進行統計,發現耐藥組中的中性粒細胞占比明顯低于響應組,而巨噬細胞占比則明顯高于響應組。
02 中性粒細胞重聚類鑒定出一個獨特的NEU亞群
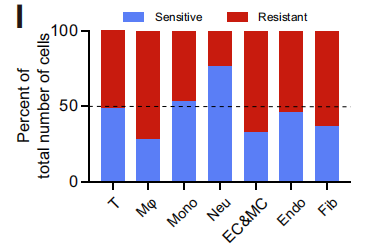
考慮到中性粒細胞在兩組中出現明顯的占比區別,研究者將4,596個中性粒細胞(約占總細胞的14.5%)進行重聚類,得到7個亞群(NEU1-NEU7)。其中,NEU1主要存在于耐藥組中,高表達免疫抑制的基因,富集抑制免疫功能的通路,且高表達JAML和CD170兩個顯著代表前體中性粒細胞免疫抑制功能的基因;而NEU3–6亞群表主要表達抗腫瘤免疫的基因,且PDL1在NEU3和NEU4中特異性富集。
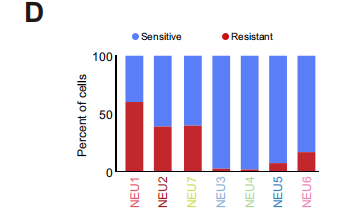
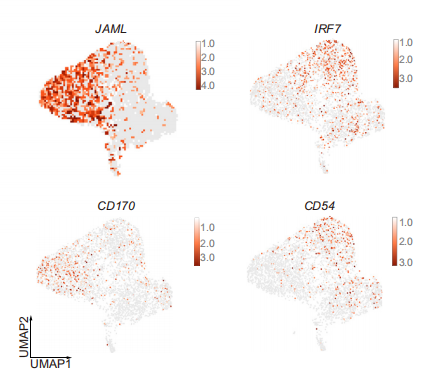
為了研究NEU1細胞和其他細胞群體之間關系,研究人員進行了速率分析和擬時序分析,發現NEU1 群體位于發育的起點,且特異性表達CD10、ALPL、JAML基因。因此將NEU1細胞群體命名為CD10+ALPL+ NEU。
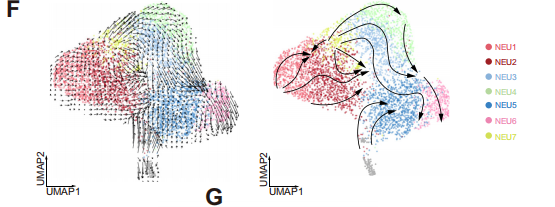
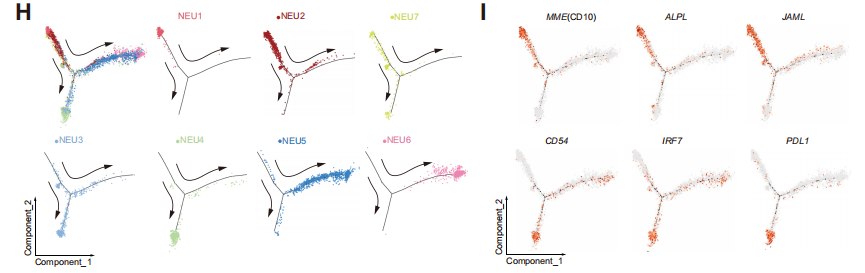
以上結果確定了不同的中性粒細胞亞群,其獨特的分布模式與HCC患者免疫治療的療效相關,并進一步表明NEU1可能是一種潛在的免疫抑制群體,是患者產生耐藥性的關鍵。
03 不同亞群的耗竭T細胞對抗PD-1治療的反應
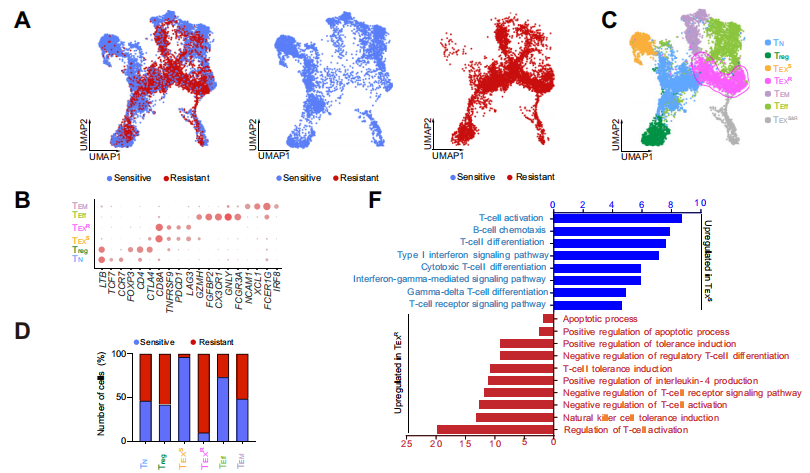
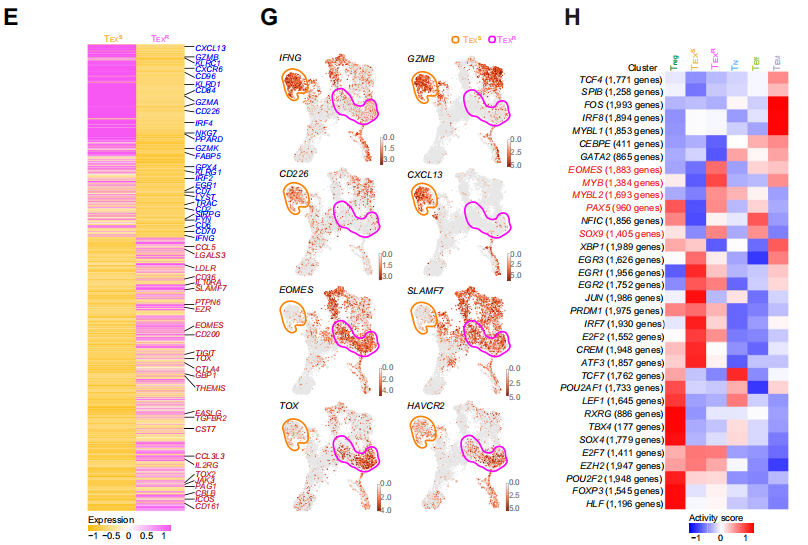
通過進行SCENIC分析,研究人員進一步比較了敏感組和耐藥組轉錄因子的活性,發現TEXS細胞中明顯豐富的EOMES活性,據報道,EOMES可介導耗竭T細胞分化和持續的T細胞衰竭。表明抗PD -1耐藥患者的TEXR細胞可能處于衰竭狀態,且這種耗竭是不可逆的。
04 CD10+ALPL+ NEUs促進T細胞的不可逆耗竭
為了深入了解CD10+ALPL+ NEUs與T細胞之間的調控關系,研究人員進行了細胞-細胞相互作用分析(CellPhoneDB)。結果表明,耐藥患者中分析到CD10+ALPL+ NEUs和TEX細胞之間的相互作用是敏感組的兩倍。
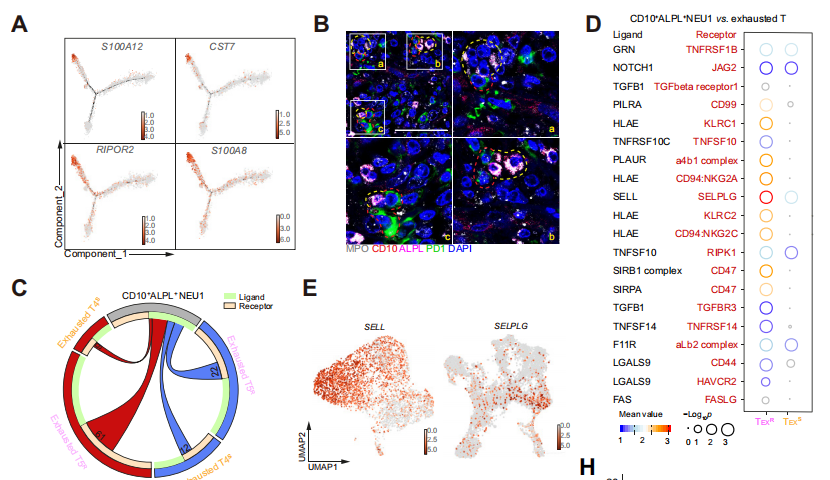
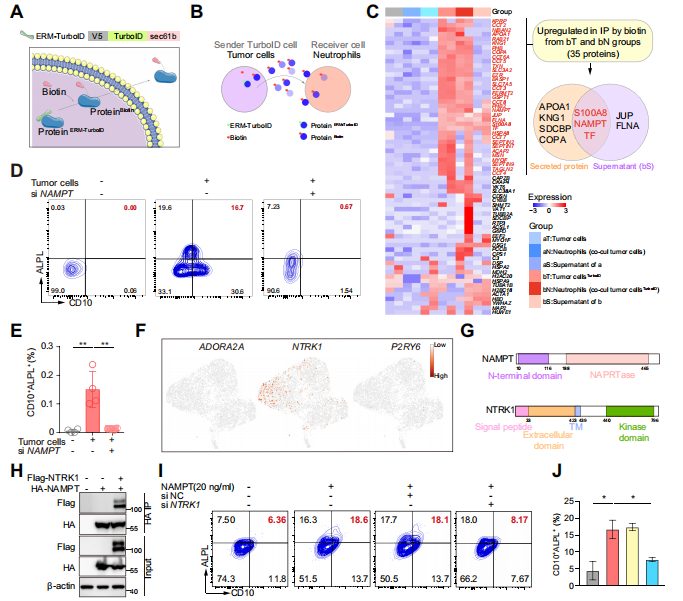
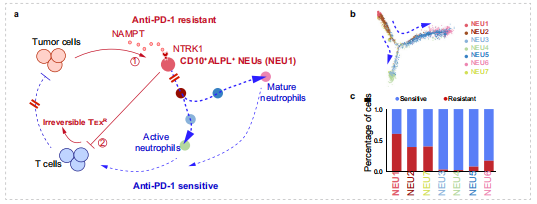
總的來說,腫瘤細胞通過NAMPT-NTRK1信號通路對CD10+ALPL+ NEUs進行重編程,維持未成熟狀態,抑制CD10+ALPL+ NEUs的成熟和激活,而CD10+ALPL+ NEUs使T細胞處于不可逆的耗竭狀態,導致了患者產生耐藥性。
原文鏈接:
https://doi.org/10.1016/j.jhep.2023.08.024